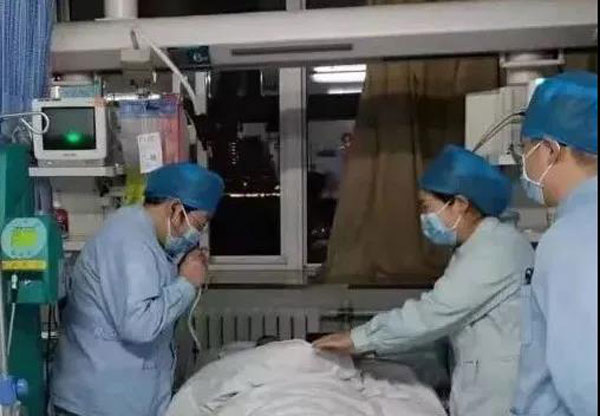
日前,国际医学期刊《欧洲分子生物学组织分子医学》以封面文章形式发表了一项研究报告,在这项由中山大学附属第一医院器官移植中心专家牵头,德、美等国科学家参与的研究中,团队利用国际首创的“离体大脑养护技术”,成功“救活”了一个与身体分离50分钟的猪大脑,恢复了大脑功能并保持了一定时间的活力。
猪脑被“救活”还能恢复大脑功能
心脏骤停患者常发生严重的脑损伤,是导致死亡的主要原因。既往研究认为,大脑仅能耐受5至8分钟缺血损伤,这导致心脏骤停患者抢救成功率极低。因此,心脏停跳5至8分钟也被称为临床死亡期。
这项研究以猪作为实验对象,首先使猪心脏停跳,随后将其大脑与身体分离。50分钟后,研究人员将离体的大脑与体外生命支持设备通过插管连接,形成一套支撑大脑复苏的生命系统。结果显示,该猪大脑被成功“救活”,能够恢复大脑功能并保持一定时间的活力。研究团队在6小时后主动终止了实验。
这套设备采用该团队自主研发的“离体大脑养护技术”,其中不仅含有人工心脏、人工肺脏部件,还利用血液常温灌注技术养护着一个活的猪肝脏,为接入设备的离体猪大脑提供新鲜、有氧、代谢稳定的血液循环。
研究显示,单纯心肺复苏系统支持下,离体大脑水肿明显,神经细胞活力显著下降,大脑电生理活动逐渐消失;而在体外心肺肝复合生命系统的支持下,离体大脑的水肿显著减轻,神经细胞的活力和细胞显微结构得到明显改善,可恢复并维持脑电活动。这表明肝脏在心脏骤停后脑损伤的修复机制中起着关键作用。
研究成果为心跳骤停抢救

提供了新策略
这项研究由中山一院器官移植中心主任何晓顺牵头,德国移植协会前任主席比约恩·纳尚、美国克利夫兰医学中心炎症与免疫中心专家安德烈娅·施莱格尔等多名科学家参与。
何晓顺是中山一院器官移植中心学科带头人,无缺血器官移植技术的首创者,破解了器官缺血再灌注损伤的难题。他实施了亚洲首例成功的多器官移植,建立简化式多器官移植技术体系,为多脏器终末期疾病提供了治愈手段;开展了我国首例公民捐献的肝移植,攻克心脏死亡器官捐献技术难关,获国家科技进步一等奖提名;主持开展了澳门首例肾脏移植等。在近日发布的第七版全球前2%顶尖科学家榜单中,何晓顺入选“年度科学影响力排行榜”。
何晓顺表示,此次研究成果为心跳骤停抢救提供了新策略,未来有望提升心脏骤停患者抢救成功率,并为脑科学研究提供全新的平台。
采写:南方+记者 卞德龙
制首乌的功效与用法有哪些
据现代医学研究,何首乌含有卵磷脂,以及大黄酚、大黄素和大黄酸等恩昆物质,能与胆固醇结合,减少肠道对胆固醇的重吸收,降低血脂,防止动脉粥样硬化,对人型结核菌等也有抑制作用.何首乌所含大黄酚还能促进肠道运动,防止便秘.何首乌一般无副作用,但可滑肠并引起轻微腹泻,因此大便溏泻者不宜服用.运用时根据不同的需要其用法亦有差别:生用偏于泻,因此治疗便秘、瘰疬等可直接切片或晒干后的生首乌片;制用偏于补,那么治疗肝肾两虚时一定要用经过炮制的“制首乌”.炮制的办法是:用黑豆煮汁,拌首乌片上笼蒸后晒干即可,药店内均能买到制首乌.用于虚烦不眠、多梦等就要选用其藤茎夜交藤了.家常味饨鸡汤:其配方为:1、乌鸡一只约800克,制首乌50克,生姜一块,水适量,文火煎煮,肉烂汤浓时加各种调料,饮汤食肉.用于美发养颜,其效甚佳.2、制首乌20克水煎20分钟,去渣取汁,用汁煨核桃仁20克,猪脑100克同煎,熟后加调料服食,间日一次,直至长出新发.具有补肾健脑之功.适用于肾虚所致的斑秃或全秃.3、何首乌60克,熟地、山萸肉、核桃、枸杞子各50克,黑豆500克.先将枸杞子、何首乌、熟地、山萸肉加水同煮;取汁再煮直至核桃肉稀烂,全部被黑豆吸收为度,取出晾干即可食用.每日二次,每次6~9克,早晚空腹服用.治疗肾虚所致的白发疗效甚佳.
何首乌可否与生熟地黄一起煮水喝?

何首乌具有补肝肾,益精血,乌须发,强筋骨之功效。 主治精血亏虚,头晕眼花,须发早白,腰酸脚软,遗精,崩带等证。 《本草备要》记载:“补肝肾,涩精,养血祛风,为滋补良药。 ”《开宝本草》云:“益气血,黑髭鬓,悦颜色,久服长筋骨,益精髓,延年不老。 ”何首乌传说可以乌发,如果给长黄头发的白人用了会有什么效果呢?难道他们的头发也会变黑吗? 可见有些中医的内容,没有科学实验,都是以讹传讹。 科学在不断发展,我们不应该死抱古代医书,很多内容有错误,却没有人敢挑战。 西医的内容在不断更新,中医也应该放弃那种医书越古老,越有效的错误观点。 (1)促进造血功能小鼠皮下注射首乌液0.2g,每日2次,连续给药3日,可使粒系祖细胞的产率明显高于生理盐水对照组。 小鼠腹腔注射何首乌提取液50mg/kg连续给药3日,可使骨髓造血干细胞明显增加,还可显著提高小鼠粒一单系祖细胞产生率,并使骨髓红系祖细胞值明显升高。 (2)增强免疫功能何首乌对强的松龙和环磷酰胺引起的老年小鼠脾、胸腺抑制性改变有明显对抗作用,使脾巨噬细胞的吞噬率和吞噬指数明显提高。 饲喂首乌乙醇浸膏能明显提高老年大鼠外周淋巴细胞 DNA的损伤修复能力。 小鼠灌服制首乌 6g/kg,连续给药 7日,能明显提高腹腔巨噬细胞的吞噬能力,对强的松龙引起的吞噬指数下降,有明显的对抗作用。 何首乌水煎醇提物对小鼠T淋巴细胞及B淋巴细胞免疫功能均有增强作用,前者作用更为显著。 何首乌提取物25-100mg/kg,腹腔注射,连续给药3日,可显著提高正常小鼠由ConA诱导的胸腺和脾脏T淋巴细胞增殖反应;皮下注射5-100g/kg,连续3日,可明显增加正常小鼠脾脏抗体形成细胞数,以50g/kg组作用最显著。 (3)降血脂与抗动脉粥样硬化高脂血症大鼠每日灌胃何首乌 4g/kg,连续 10日,能较显著地降低大鼠血清总胆固醇(TC)及血清甘油三酯(TG)的含量。 对于高脂血症鹌鹑,连续灌胃首乌4周,可明显降低血清TC含量和提高HDL/TC比值。 另有实验证明,高脂血症及动脉粥样硬化模型家兔,何首乌灌胃7日,不仅能降低TC含量,还能减轻动脉粥样硬化斑块形成。 何首乌水提液 32g/kg喂养小鼠1个月,能明显提高 HDL- C水平。 何首乌掺入到饲料中喂养大鼠,90日后,也可明显升高HDL-C,而TG和TC无明显变化,对β脂蛋白有明显抑制作用。 何首乌醇提取液给快速动脉粥样硬化鹌鹑灌胃,连续6周,血浆HDL-C/TC比值显著升高,大剂量组作用更为显著。 各给药组均有延缓动脉粥样硬化的作用。 何首乌降血脂与抗胆固醇作用的有效成分包括蒽醌类、二苯烯化合物以及卵磷脂等。 (4)保肝何首乌所含的二苯烯化合物对过氧化玉米油所致大鼠脂肪肝和肝功能损害,肝脏过氧化脂质升高、血清谷丙转氨酶及谷草转氨酶升高等均有明显对抗作用,并使血清游离脂肪酸及肝脏过氧化脂质含量下降。 在体外能抑制由ADP、NADPH引起的大鼠肝微粒体脂质过氧化。 何首乌还有增加肝糖原作用。 生首乌、黑豆汁制首乌和清蒸首乌水煎液对醋酸强的松所致肝脂蓄积有对抗作用,可降低CCl4引起的肝肿大,使肝重系数降低。 (5)延缓衰老,现代调查有维生素E制止皱纹再生。 给404日龄的老年喂饲含首乌粉的饲料190日,能明显延长老年鹌鹑半数死亡时间。 何首乌可延长果蝇二倍体细胞的生长周期,使细胞生长旺盛,延长果蝇的寿命。 大鼠灌服何首乌醇溶部位和水溶部位都能促进细胞分裂增殖,延长大鼠皮肤二倍体成纤维细胞的传代数。 何首乌水煎液给老年小鼠喂服,能降低脑内MAO-B活性,提高脑组织中5-HT、NE及DA含量。 赤首乌、白首乌混合制剂及赤首乌煎剂对大鼠、小鼠离体脑内MAO-B活性均有显著抑制作用。 老年大鼠服用何首乌2个月,能改善老年大鼠纹状体多巴胺能神经系统的功能。 何首乌水煎液喂服老年小鼠或青年小鼠,能使脑和肝中蛋白质含量明显增加,提高老年机体DNA修复能力。 何首乌的醇提物及水提物能不同程度地增加老年大鼠胸腺胞浆蛋白和核酸含量。 何首乌延缓衰老作用与抗氧化作用有关。 老年小鼠灌服何首乌水煎浓缩液,能明显增强血中SOD活性。 炮制对首乌抗氧化作用有一定影响,新法炮制品及老法炮制品均有明显提高小鼠全血及脑组织SOD活性作用,并能降低小鼠心、肝、脑组织中及血中LPO含量,生品对SOD和LPO无明显影响。 首乌醇提液或水提提液均能不同程度地提高老年大鼠心、肝、脑的组织SOD含量和降低LPO含量。 (6)对内分泌的影响何首乌水煎浓缩液长期给小鼠灌胃,可使小鼠肾上腺重量明显增加。 何首乌还有类似肾上腺皮质功能的作用,对摘除双侧肾上腺的小鼠,可使其应激能力明显提高,减少冷冻引起的小鼠死亡率。 制首乌对去甲肾上腺素饥饿小鼠肝糖原积累,有促进作用,使肝糖原明显增加。 何首乌对血糖的影响有一定的时效关系,给家兔口服首乌煎剂后30、60分钟内血糖升高达峰值,之后逐渐下降,6小时后血糖比正常低。 大鼠肝胰岛素受体具有高亲和力低容量,及低亲和力高容量两种受体,老年小鼠结合容量显著降低,但亲和力无变化。 何首乌对容量和亲和力两个参数均无明显影响。 (7)润肠通便何首乌生用,润肠通便作用强,其有效成分大黄酚可促进动物肠管运动。 部分高脂血症病人服用后,出现大便次数增加和腹泻现象。 2.其他药理作用曾有报道,何首乌各种炮制品(生首乌、酒蒸首乌、黑豆汁蒸首乌、清蒸首乌)水煎液体外对金黄色葡萄球菌、白色葡萄球菌、福氏痢疾杆菌、宋内氏痢疾杆菌、伤寒杆菌901、副伤寒杆菌从白喉杆菌、乙型溶血性链球菌等均有不同程度的.抑制作用,其中生首乌煎剂抗金黄色葡萄球菌作用比其他炮制品强,制首乌水煎剂对白色葡萄球菌,酒蒸首乌水煎剂和地黄汁蒸首乌水煎剂对白喉杆菌的抑制作用比其他首乌强。 何首乌对流感病毒有一定抑制作用。 此外,何首乌还有减慢心率、扩张冠脉、抗心肌缺血等作用。 综上所述,与何首乌补肝肾,益精血,乌须发,强筋骨功效相关的药理作用是促进造血功能,提高机体免疫功能,降血脂,抗动脉粥样硬化,保肝,延缓衰老,影响内分泌功能,润肠通便等作用。 何首乌功效作用的物质基础主要为磷脂、蒽醌类、葡萄糖苷类等成分。 至于补肾方面,哪是纯粹的商家为了扩大药物的治疗效果而瞎编乱造的,目的是为了让大家都购买何首乌,大家不要亲信。 生地黄:性味 鲜生地性寒,味甘、苦。 生地黄性寒,味甘。 熟地黄性寒,味甘。 功能主治 鲜地黄清热生津,凉后,止血;用于热风伤阴、舌绛烦渴、发斑发疹、吐血、衄血、咽喉肿痛。 生地黄清热凉血,养阴,生津;用于热病烦渴、发斑发疹、阴虚内热、吐血、衄血、糖尿病、传染性肝炎。 何首乌可与生熟地黄一起煮水喝,但是脾胃虚寒者不宜.

化学蛋白质组学揭示可溶性环氧化物水解酶作为眼部新血管形成的治疗靶标

用于治疗眼部新生血管疾病,如老年湿性眼底黄斑变性(wet AMD)的标准治疗药物是靶向血管内皮生长因子VEGF信号传导的生物制剂。 然而,FDA目前尚未批准通过用于治疗这些致盲眼病的小分子药物。 因此,具有新机制的治疗剂对于补充或与现有方法相结合是至关重要的。 在这里,我们确定了可溶性环氧化物水解酶(sEH),一种环氧脂肪酸代谢的关键酶,作为抗血管生成的小分子SH-的靶点蛋白。 SH-在体内外均能抑制sEH,并对接到sEH水解酶结构域中的底物结合位点。 在脉络膜新生血管(CNV)小鼠模型中,sEH水平和活性被上调。 sEH在湿性AMD病人眼中过度表达,表明sEH与新血管形成有关。 已知的sEH抑制剂递送眼内可以抑制血管增生。 因此,通过解剖生物活性化合物的机制,我们确定了sEH抑制的新化学小分子类型,并将sEH表征为阻断湿性AMD下面的CNV的靶标。 眼部新生血管形成是导致婴儿、工作年龄的成年人以及老人失明的根本原因。 目前,FDA批准的湿性AMD治疗主要集中在使用雷珠单抗和阿柏西普等生物制剂抑制血管内皮生长因子(VEGF)信号通路。 尽管这些治疗剂成功,但它们与抑制这种主要血管生成途径引起的眼部和全身副作用以及耐药和难治性患者群体的存在相关联,使其使用复杂化。 因此,发现新的治疗靶点至关重要,以提供替代的血管生成靶标,这些靶标可以与现有药物相互补充和结合。 我们的研究使用无偏向前化学遗传学方法来鉴定可能是可药用的血管生成介质的SH-蛋白质靶标。 我们合成了两种光亲和试剂,用于从猪脑裂解物中提取蛋白质结合配偶体。 其中一种试剂能够将特定的蛋白质靶标,即可溶性环氧化物水解酶(sEH),下拉出来。 我们通过免疫印迹证实了下拉蛋白的特性。 SH-与sEH的对接显示了一种结合模式,其中化合物几乎占据酶的整个活性位点。 SH-的同型异黄酮类基团占据sEH的催化Asp335和Tyr466残基所在的位点。 同型异黄酮类的两个芳环都参与与包括His524和Trp336的sEH残基的π-π相互作用。 SH-的肽部分的苄基取代基位于由Trp473、Met503、Ile363和Phe362产生的疏水腔中。 取代基位于开口附近,2或3的连接基通过该开口附在SH-上。 广泛的分子动力学模拟显示该部分是柔性的,如SH-的均方根偏差所示,范围从1.2到2.8。 分子动力学模拟的动画显示苯环周期性地采用构象,由此环的对位暴露于溶剂。 sEH是编码EPHX2的62kDa双功能酶,具有N-末端脂质磷酸酶(EC 3.1.3.76)和C-末端环氧化物水解酶(EC 3.3.2.10)活性。 虽然尚未完全了解sEH的脂质磷酸酶活性的生理作用,但由于其在花生四烯酸环氧化物衍生物,环氧二十碳三烯酸(EET)的代谢中的作用,其环氧化物水解酶活性已被广泛研究。 EET具有促血管生成作用,导致肿瘤生长加速,并在高血压、疼痛和炎症中发挥作用。 因此,sEH抑制剂已经用于治疗相关病症的临床试验。 此外,sEH参与ω-3脂肪酸,二十二碳六烯酸(DHA)和二十碳五烯酸(EPA)的环氧化物的代谢,其在眼睛中比EET更丰富。 在鉴定sEH作为SH-的结合靶标后,我们测试了该化合物与已知的sEH抑制剂相比是否在体外干扰sEH的环氧化物水解酶活性。 SH-以浓度依赖性方式体外抑制sEH酶活性,尽管不如特异性抑制剂t-AUCB或7有效。 然而,SH-的结构特征与sEH特异性相互作用。 酶动力学分析表明,增加浓度的SH-降低了V max并增加了K M,表明SH-是sEH的混合型抑制剂。 此外,sEH的催化机制通过Asp残基作为亲核攻击进行到环氧化物底物上,这导致四面体中间体,需要活化水释放二醇并再生游离酶。 鉴于sEH具有两种底物(在我们的测定中,荧光底物3-苯基-氰基(6-甲氧基-2-萘基)甲酯-2-环氧乙酸[PHOME]和水)并且涉及共价中间体,因此可能SH-可以在催化循环后期结合并稳定酶物质,其仍然与游离酶构象平衡。 在这种酶种类的活性位点结合的SH-可能不与底物竞争。 总之,这些发现表明SH-代表了来自已知sEH抑制剂的新型独特化学型。 在建立SH-对sEH活性的体外抑制后,至关重要的是评估先前记载的SH-的抗血管生成作用是否通过L-CNV模型中sEH的抑制来介导。 因此,我们在CNV诱导和玻璃体内注射10μMSH-或t-AUCB后3天的急性时间点分析了来自小鼠的视网膜/脉络膜层的脂质谱。 有趣的是,19,20-环氧二十碳五烯酸(EDP)及其二羟基代谢物,19,20-二羟基二十碳五烯酸(DHDP)是受sEH抑制影响最大的DHA代谢物。 诱导新血管形成后,19,20-EDP与19,20-DHDP的比率降低,表明在这些条件下sEH活性增强。 然而,该比例为SH-或后部分正常化吨相比载体处理的对照-AUCB治疗,表明了sEH抑制体内。 sEH在各种组织中广泛表达,在神经元细胞体和星形胶质细胞中在肝、肾和脑中观察到最高水平的表达。 在小鼠眼发育中,它在Müller神经胶质细胞中表达,并在新生小鼠的氧诱导的视网膜病中,在视网膜神经节细胞、新血管和内核层神经元中观察到表达。 我们的数据表明成年小鼠眼中的差异表达模式,特别是在CNV应激下。 反过来,老年人的眼睛有另一种表达模式,但这也可能是一种物种差异:在杆状显性,夜间小鼠眼中对CNV反应所见的杆特异性sEH表达可能会被其他人共享正如我们所观察到的,细胞类型在锥形显性人黄斑中。 一些研究表明,在遗传操作或饮食或腹腔注射给药后,DHA及其环氧化物在眼睛中具有有效的抗血管生成作用。 然而,迄今为止,使用小分子对sEH的抑制仅在L-CNV中通过ip注射进行全身给药进行了测试,并且仅在饮食补充ω-3时显示出抗血管生成作用。 鉴于导致EET形成的花生四烯酸途径在系统上占主导地位,与眼睛不同,全身sEH抑制后EDP累积的影响可能被伴随的促血管生成EET积聚部分抵消。 因此,局部sEH抑制是吸引人的。 为了解决这个问题,我们尝试使用玻璃体内注射局部测试sEH抑制剂,以最大限度地减少任何全身副作用,并专注于了解sEH在眼睛中的作用。 我们之前表明,在这种情况下,SH-在≥1μM的剂量下是有效的。 在这里,为了验证sEH作为关键目标,我们评估了两种化学上不同的sEH抑制剂,在L-CNV中的抗血管生成作用。 与载体相比,单次注射t-AUCB或化合物7剂量依赖性地抑制CNV病变血管体积,与标准的护理等效抗VEGF 164抗体相当,表明确实直接在眼中的sEH抑制不需要ω-3补充抗血管生成功效。 此外,为了证实我们在不同模型系统中的观察结果,我们在脉络膜发芽测定中测试了t-AUCB和化合物7,作为CNV的离体模型。 有趣的是,t-AUCB和化合物7都抑制了脉络膜组织形成芽的能力。 先前已经在 L-CNV模型和湿性AMD患者体内报道了ω-3多不饱和脂肪酸(PUFA)水平对脉络膜新血管形成的影响。 有趣的是,在sEH基因敲除小鼠的视网膜中,观察到与野生型对照小鼠相比,19,20-DHDP水平的显著变化,而不是DHA的环氧代谢物。 此外,19,20-DHDP可以挽救用这些小鼠观察到的抑制的发育性视网膜血管发生表型,并且如所指出的,在L-CNV小鼠模型中腹膜内注射19,20-EDP抑制了CNV损伤体积。 虽然对sEH抑制或敲除后其他EDP没有变化的解释尚不清楚,但DHA环氧(19,20-EDP)和二醇(19,20-DHDP)代谢物和sEH的活性可能是观察到的视网膜和脉络膜血管生成变化的主要因素,而不是DHA水平本身。 总之,我们的研究结果不仅揭示了抗血管生成分子的目标和sEH抑制的新型化学型,而且还揭示了局部sEH在眼部新血管形成中的核心作用。 开发新的,眼部特异性sEH靶向疗法是补充或与现有抗VEGF药物组合以克服其局限性并解决多种血管生成信号传导途径以改善湿性AMD治疗的可能方法。 我们已经证明SH-可以与L-CNV中的抗VEGF抗体协同作用。 另外,可以在包括PDR和ROP在内的其他眼部新生血管疾病中进一步研究sEH及其对使用SH-等小分子的抑制作用。





